首页>新闻>365下注平台之CHO-K1悬浮规模化放大培养及蛋白抗体规模化生产
365下注平台之CHO-K1悬浮规模化放大培养及蛋白抗体规模化生产
一.前 言
目前,哺乳动物细胞的大规模培养与表达已成为生物药生产特别是抗体药生产的基石技术。与酵母等其它真核细胞系相比,哺乳动物细胞表达外源蛋白的优势在于可表达含有复杂二硫键或翻译后修饰的靶蛋白,且蛋白可分泌到培养液中,其产物蛋白的糖基化程度高且均一,有效提高药效,同时减少药物副作用。中国仓鼠卵巢细胞(CHO)是目前重组蛋白生产领域最具代表性的工程细胞,其具有高效扩增和表达的特点,在流加培养中单抗产量最高可超过10g/L。据统计,使用CHO工程细胞系作为表达载体开发的抗体药物超过60%。CHO细胞株类型有CHO-S、CHO-ZN、CHO-DG44以及CHO-K1等,其中CHO-K1是其中重要的衍生细胞株类型,被广泛地用于重组DNA蛋白的表达。在新冠疫苗的研发生产上,被应用于重组亚单位疫苗的开发生产。
细胞与组织培养是生物制药产业的支撑技术,而培养基是公认的细胞与组织培养中的最关键因素。随着生物制药大规模细胞培养技术的发展,制药企业对培养基的需求量越来越大,品质等级要求也越来越高,采用更先进的细胞培养技术和培养基,可提高单位体积培养液中疫苗或抗体的表达量,从而提高疫苗或抗体药物生产能力、降低生产成本。近年来,我国培养基行业正在蓬勃发展,产能和品质都在提升,但目前无论国际还是国内的大分子药用无血清培养基市场,国际品牌的市场份额及认可度仍占有一定优势。自新冠疫情爆发以来,由于新冠疫情影响以及培养基需求量的急剧增加,导致全球范围内培养基严重缺货,而国产培养基替代效果不佳,导致进口培养基供应严重吃紧、价格不断飙升以及交付时间延长和采购受限等问题。为了有力保障生物制药技术发展,开发生产国产化自主高品质培养基,摆脱进口培养基依赖,建立强大的培养基自研及产业化生产能力,实现国产化替代的需求十分迫切。

二.CHO-1CDM 08完全化学成分限定无血清培养基
产品介绍:
CHO-1CDM08培养基为无动物源、无蛋白的完全化学成分限定培养基。适应于CHO细胞规模化无血清悬浮放大培养及后续转染表达。用于治疗性蛋白相关产品研发和生产过程,可支持细胞高密度扩增及稳定的产物表达,对CHO-K1更具优势。为了适应不同培养体系及蛋白生产工艺,配套培养基产品提供对应补料产品,同时也可匹配其他商业化补料产品。
产品信息:

产品优势:
无动物源、无蛋白、完全化学成分限定的培养基产品;
适用于CHO-K1细胞高密度悬浮培养,适应性强,营养物质丰富;
适于生物反应器大规模放大培养工艺,支持批次、流加及灌流培养模式;
可有效支持转染及后续产物表达,保障单克隆抗体以及融合蛋白的稳定高质量表达;
采用高品质原料配制,关键原料采用进口原料,产品的质量以及稳定性高;
cGMP标准条件生产,采用连续式针磨设备进行粉末培养基生产,产品一致性高,批间差小。
三、CHO-1 CDM08应用于CHO-K1悬浮规模化放大培养及蛋白抗体规模化生产
3.1 CHO-K1细胞生长曲线图-CHO-1CDM08
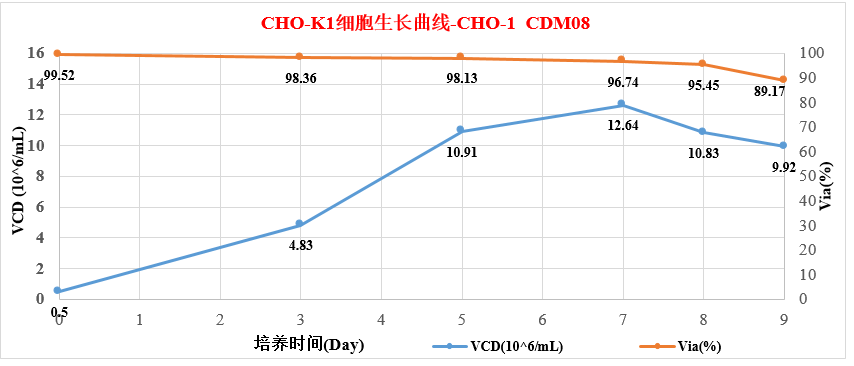
从图中可以看出,在摇瓶Batch培养过程中,细胞维持快速生长同时细胞活率一直维持在95%以上,PeakVCD达12.64×10^6cells/mL。
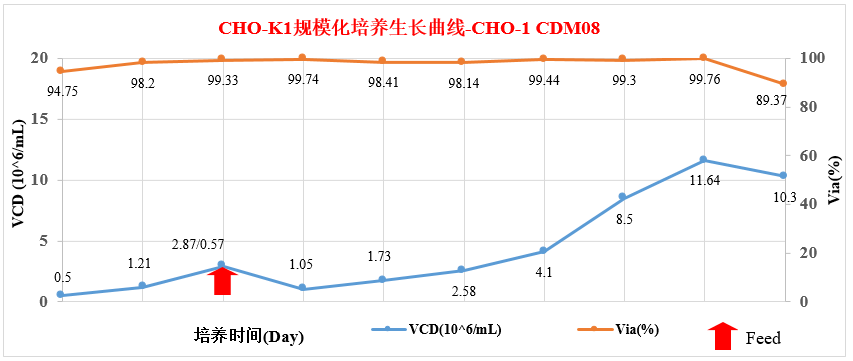
3.2 CHO-K1规模化培养生长曲线图-CHO-1CDM08
3.3 CHO-K1细胞传代稳定性曲线-CHO-1CDM08
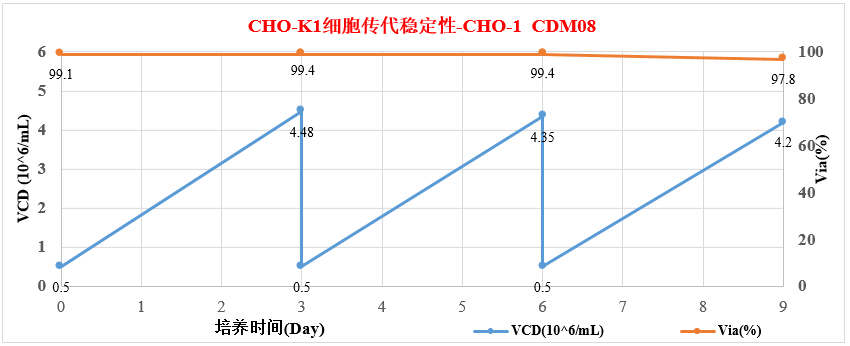
初始接种密度为0.5×10^6cells/mL时,72h扩增至4.0×10^6cells/mL以上,细胞扩增8倍以上,平均倍增时间低于24h,稳定性良好。
3.4 蛋白质表达量对比测试-CHO-1CDM08
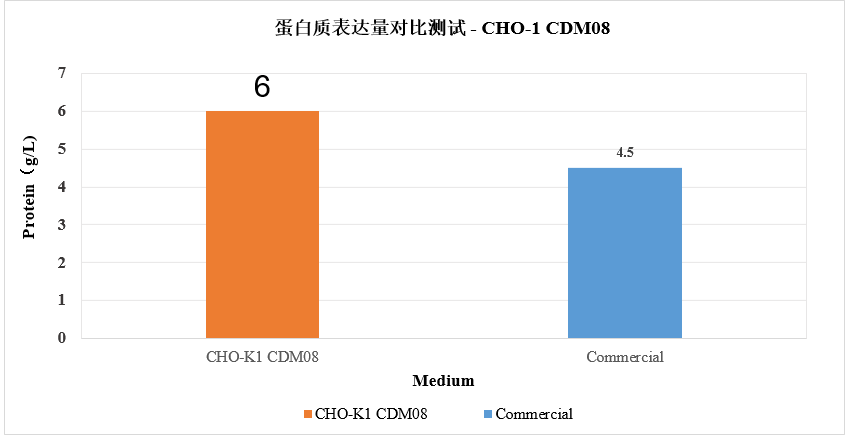
从图中可以看出,CHO-1CDM08应用于蛋白表达,蛋白表达量具备优势。
四、结语
CHO-1CDM08培养基为无动物源、无蛋白的完全化学成分限定培养基,适应于CHO-K1细胞规模化无血清悬浮培养及后续转染表达。适用于CHO-K1悬浮规模化放大培养及抗体蛋白表达生产,可有效替代进口培养基用于生物药研发及大规模生产。
参考文献
1.Kumar,S.R., 2015. Industrial production of clotting factors: Challenges ofexpression, and choice of host cells. Biotechnol. J. 10, 995–1004.
2.H.G.Hansen, N. Pristovšek, H.F. Kildegaard, G.M. Lee, Improving thesecretory capacity of Chinese hamster ovary cells by ectopicexpression of effffector genes: lessons learned and futuredirections, Biotechnol. Adv. 35 (2017) 64–76, http://dx.doi.org/10.1016/j.biotechadv.2016.11.008.