首页>新闻>365下注平台之容器封闭完整性测试(CCIT)-从法规到生产(上篇)(精选)
365下注平台之容器封闭完整性测试(CCIT)-从法规到生产(上篇)(精选)
引 言
无菌产品的容器密封系统应能防止微生物侵入,在密封产品的检查过程中,应查出并剔除有损坏或缺陷的产品。要有严格的安全措施,防止由于密封完整性缺陷导致污染的产品投放市场。不断更新的法规要求在药品保质期内进行容器密封完整性评估。另一方面,仅采用目检(灯检)并不被视为可接受的完整性测试方法。但全球或当地的监管要求对如何评估产品保质期结束前的容器密封完整性(CCI)以证明微生物质量(无菌)没有提供实际指导。制药行业需要解决的实际问题和考虑的因素有:CCIT方法的选择、验收标准、阳性对照样品等——企业必须制定CCIT策略。
本文及后续的内容将会对容器密封完整性测试展开讨论。
CCIT的意义和目的
容器密封完整性(CCI)是容器密封的能力,以保持无菌产品在其保质期内的质量,数量和无菌性等。容器封闭完整性测试(CCIT)旨在测试并确认容器已正确密封,不允许产品内部受到污染或有产品溢出。
注射剂容器密封完整性测试(也称为检漏),在过去几十年中变得越来越重要。较为理想和直接的方法是逐瓶测试容器的密封完整性,但受限于之前的工业发展状况和成本较高的原因,除对通过熔封方式密封的注射剂要求100%检漏外,目前对无菌药品的逐瓶完整性测试应用尚不普遍,国际上普遍接受基于容器密封系统设计、密封组件生产、密封完成、密封完整性验证的质量保证过程,以证明成品的密封性。
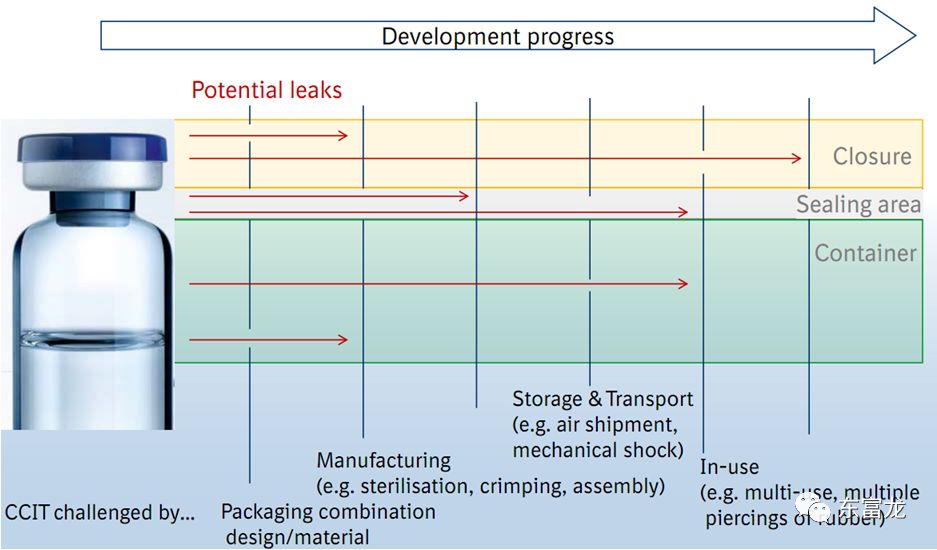
无菌药品的容器密封完整性受到生产及储运过程中多种因素影响,不同阶段有不同的任务。容器密封完整性测试(CCIT)通常应在三个阶段进行:
(1)产品包装系统的初始开发;
(2)常规制造;
(3)保质期稳定性评估。
上述工作又可以分为两个不同的过程:设计和首先验证容器及其密封系统,然后是制造后的检验。
1、 产品包装系统的开发阶段,首先是选择和设计容器及其密闭系统,确保产品不仅在制造后而且在其整个有效期内的稳定性和完整性。其次,其需验证这个设计一个好的容器封闭系统的设计和验证涉及到以下几个方面:
◆ 容器所用材料必须在不影响产品特性的情况下足够稳定,以确保其在与内部产品接触时的安全性(即无菌),并且不能影响产品的医疗功效。
◆ 必须阻止外部气体、液体、微生物和其它进入和接触产品的异物或产品外泄。如果是光感产品,容器必须能够挡住大部分光线保护产品,特别是高频的蓝光或紫外线。
◆ 在产品的整个保质期内,它还必须能够承受温度变化和预期的机械搬运、拆卸和移动,包括制造、包装、运输、储存和使用期各阶段容器的封闭系统必须能够提供与产品灌装和最终组装后相似的完整性水平。
◆ 此外,容器密封和密闭产品必须进行类似的分析,并确认产品的整个保质期和储存使用范围内,容器和封闭系统都应该是经济的生产和管理,便于检验和质量保证,即使是没有特殊技能或知识的普通人,也能轻松、安全地进行操作,之后也能轻松、安全地在使用后处置。
这一阶段,在药品和/或灌装线的确认/验证期间进行的CCI测试步骤主要有:
◆ 装运/运输验证应包括待测试的CCI样品。
◆ 微生物学包装评价,药品原包装材料的评价。这里微生物学(mCCI)通常是在药物开发过程中进行的,表明当进行细菌侵入试验(BIT)时,胶塞/西林瓶或顶部/端盖/注射器的组合作为微生物屏障是有效的。
◆ 培养基灌装(无菌过程模拟),培养基灌装表明微生物污染控制在无菌处理过程中是有效的,药物的制备和填充受到内在和环境微生物挑战(无菌制剂)的控制。成功的(零污染单元)培养基灌装(无菌过程模拟)也证明了填充单元在制造和处理期间的有效CCI。
◆ 轧盖效果确认(以西林瓶为例),通过轧盖效果确认如测定RSF方法,以证明胶塞设置和压接适合确保西林瓶系统(胶塞、西林瓶和密封)的充分闭合。开发过程中的失效边缘CCI研究可用于确定制造公差水平。
如果我们假设容器封闭系统设计良好,那么初级包装所涉及的材料(即直接接触剂型)需具有要求的特性和稳定。当它们的配合与组装在整个产品中也很稳定和耐用,我们就可以把注意力转移到容器密封系统CCS的质量控制上。

2、目前,在日常生产阶段进行的CCI测试主要有:
◆ 用于在抽样基础上批量放行的CCI方法。在批量放行水平上的无菌检测,为批量放行进行的无菌试验是正确的CCI的证明。
◆ 包装材料放行,包装材料在使用前应进行监控和放行。这包括针筒或西林瓶和密闭系统(塞子)的尺寸规范。
◆ 在100%检查的基础上用于放行的CCI方法——目视检查。100%目视检查可去除裂纹、划痕和压接缺陷。
注:这些已识别的缺陷由光学控制系统根据存在缺陷的可能性的概率性质进行检测,并由人眼或摄像机进行识别。考虑到这一点,应认为检测与缺陷的尺寸有关。纯粹的视觉检查本身并不是监控CCI的合适工具。由于视觉系统无法评估容器密封相对于微生物挑战的稳健性,如果在批次放行前对100%的填充单元进行目视检查,则目视检查不能检测出较小的裂纹,并拒收这些裂纹。
◆ 即使没有实施100%的CCI测试,所有有助于监控CCI的活动都应按照质量风险管理方法进行总结和评估,以确保CCI得到充分和适当的保证。
◆ 当确定所总结的已建立的检测或补救方法的风险不能充分解决容器的CCI、制造方法以及对产品安全质量或功效的风险时,建立一个100%的CCI测试方法,重点是“检测最大允许泄漏率(MALR)”或“最大允许泄露极限(MALL)”,而不仅仅是样本对象的整体完整性。
注:MALR的完整性测定取决于所用方法的灵敏度,应注意不要通过检测/测试方法产生问题,该问题实际上并不表现为现场的非完整单元。
仍然有可能使用适当的产品流采样从100%CCI方法转移到破坏性CCI方法。如果CCI的抽样结果用于批量放行,则抽样计划应基于统计上适当的抽样计划。其中一个可能性是标准DIN/ISO2859-1/ANSI/ASQ 71.4的S-3或S-4级。批量放行时应注意仅依赖AQL数据。不建议只测试单个单元。然而,在许多情况下,样本量是10-20个单位,而可用于质量控制的样本量可能受到批次大小和其他考虑因素的限制,例如生物制品。
◆ 所用主要包装材料的供应商管理,应监测初级包装材料供应商的工艺变化及其对药品包装组合的CCI的影响。
3、保质期稳定性评估期间CCI测试的建议:
◆ 对于保质期稳定性评估,在无菌评估的同时,取样评估CCI。使用的CCI测试方法的缺陷检测能力应基于等于或优于微生物侵入测试。此限值可通过微生物侵入试验验证,也可基于文献中给出的限值。在产品开发之后或开发过程中确保这种CCI可能是有用的,否则它可能会导致非现实/非生产代表性缺陷的CCI缺陷的检测。
◆ 作为已识别的CCI缺陷(泄漏单元),使用具有正常生产代表性的非整体缺陷小瓶(如真实破裂的西林瓶)也很有用。
对注射剂安全性的关键要求是无菌,加上被微生物污染的药物会严重损害受药者。因此,在完整性被破坏情况下,真正的危险是外部微生物一旦进入容器,它们可能会繁殖很多,以至于当给病人用药时细菌负荷会严重影响其健康状况。
随着近年来检测技术的快速发展,大多数监管机构正迅速朝着强制所有注射剂产品做100%密封完整性测试的目标迈进。这主要基于以下两个因素:一方面,检漏测试与药品的无菌有直接关系,容器密封完整性失效后风险较高;另一方面,新的检测系统开发更加经济、可靠和在制造过程中降低成本。人们普遍认为,在未来几年内,100%的完整性测试要求将逐步扩大到各种容器和更多药典。
我们将在下一部分中看到今天在市场上可用的主要的CCIT方法。其中一些方法,如氦质谱非常精确和敏感,技术如高压放电、压力/真空衰减、基于激光法的顶空气体分析等检查快速、无损,均适用于100%的容器密封完整性检测,但它们也具有破坏性,缓慢而且价格昂贵,因此只能用于实验室控制条件。
如果,您需要更详尽了解365下注平台检漏系列产品,或根据不同的产品特性,选择相对合适的检漏机型,请随时联系我们!下期再续。
名词:
CCI: Container Closure Integrity
CCIT: Container Closure Integrity Testing
CCS: Container Closure System
BIT: Bacterial Invasion Test
RSF: Residual Seal Force
MALR: Maximum Allowable Leakage Rate
MALL: Maximum Allowable Leakage Limit
AQL: Acceptance Quality Limit
ANSI: American National Standard Institute
ASQ: American Society for Quality
参考文献:
EU GMP Annex 1, Rules Governing Medicinal Products in the European Union, Vol.4, EU Guideline to Good Manufacturing Practice, Medicinal Products for Human and Veterinary Use)
USP<1207>
FDA Guidance Paper for industry: Container and closure system integrity testing in lieu of sterility testing as a component of the stability protocol for sterile products, February 2008
Position Paper of ECA Container Closure Integrity testing of medicinal products for parenteral use. Version 2.0 (February 2020)